Qué información aporta realmente MTHFR
2/2/26
Qué información aporta realmente MTHFR

El gen MTHFR ha sido uno de los más solicitados —y también uno de los más malinterpretados— en el ámbito de la nutrigenética y la medicina preventiva. Asociado de forma simplista a fatiga, problemas cardiovasculares, infertilidad o “mala metilación”, su análisis ha generado tanto expectativas irreales como rechazo entre profesionales. Sin embargo, cuando se integra correctamente, el conocimiento genético sobre MTHFR puede convertirse en una herramienta útil para comprender variabilidad metabólica, ajustar decisiones clínicas y personalizar la suplementación.
Más allá del “tienes o no tienes el gen”: qué información aporta realmente MTHFR
En consulta, el primer aspecto a tener en cuenta al trabajar con MTHFR es desactivar el enfoque dicotómico. No existen “pacientes MTHFR” ni mutaciones patológicas per se en la mayoría de los casos, sino variantes genéticas frecuentes en la población general que modulan la eficiencia de una enzima clave del metabolismo del folato.
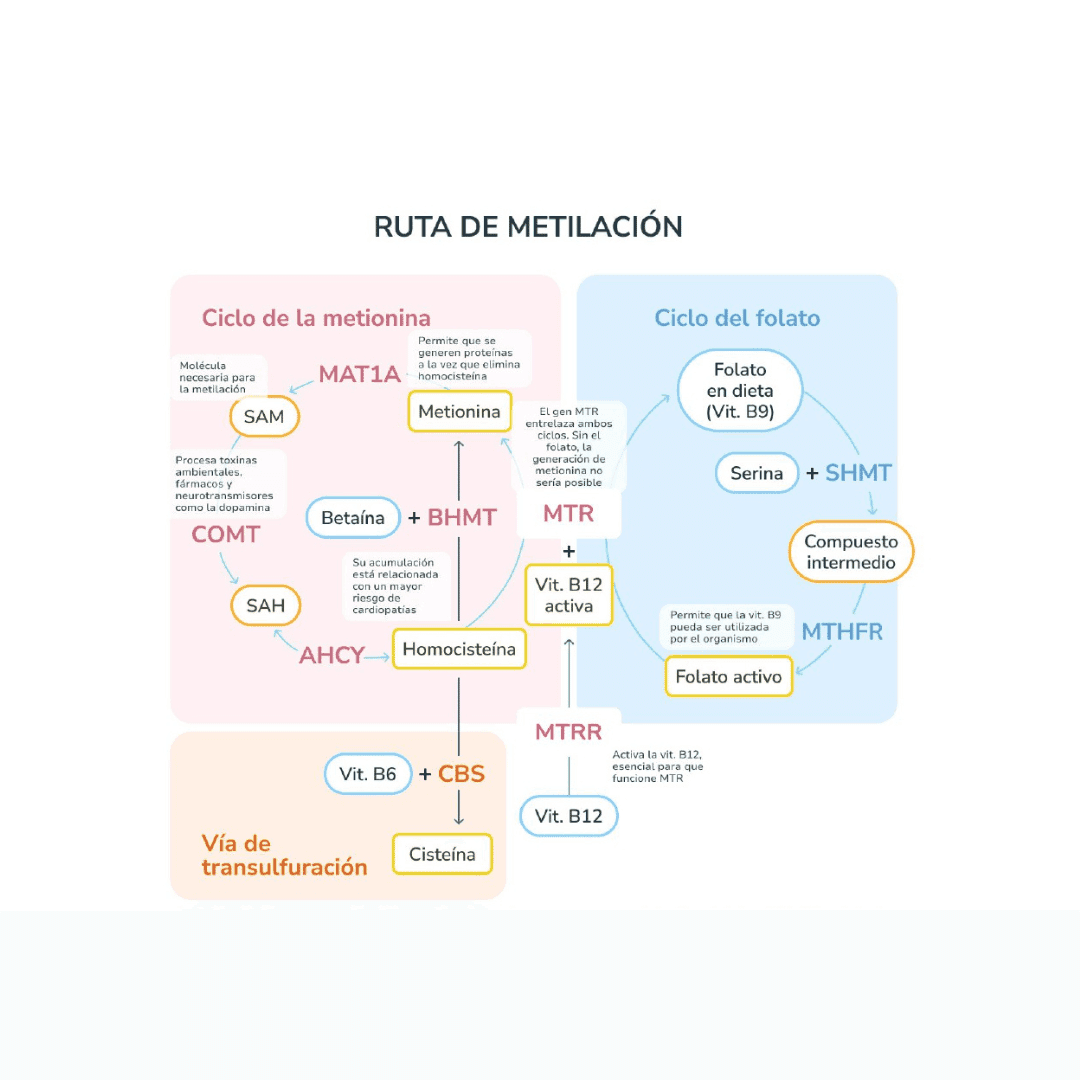
La enzima MTHFR participa en la conversión de 5,10-metilentetrahidrofolato en 5-metiltetrahidrofolato, una forma activa de folato necesaria para la remetilación de la homocisteína a metionina. Determinadas variantes genéticas se asocian con una actividad enzimática reducida, especialmente en condiciones de bajo aporte dietético de folatos, déficit de vitaminas del grupo B o mayor demanda metabólica.
Desde el punto de vista clínico, esta información no permite diagnosticar ninguna patología, pero sí aporta contexto. Ayuda a entender por qué, ante un mismo entorno nutricional o estilo de vida, algunas personas muestran mayor tendencia a presentar homocisteína elevada, peor respuesta a determinados suplementos o mayor sensibilidad a déficits funcionales de folato.
El valor clínico está en la integración, no en el gen aislado
Uno de los errores más frecuentes es interpretar MTHFR de forma aislada, sin considerar el resto de variables clínicas y bioquímicas. En la práctica profesional, su utilidad emerge solo cuando se integra con:
Analítica (homocisteína, folato sérico y eritrocitario, vitamina B12, B6)
Estado nutricional y patrón dietético del paciente
Situaciones fisiológicas concretas (embarazo, envejecimiento, inflamación crónica, estrés metabólico)
Otros rasgos genéticos relacionados con el metabolismo del folato, la metilación o el estrés oxidativo
En este contexto, MTHFR no “explica” síntomas por sí mismo, pero puede ayudar a priorizar hipótesis clínicas. Por ejemplo, ante un paciente con homocisteína persistentemente elevada pese a una dieta aparentemente adecuada, la presencia de ciertas variantes puede orientar a revisar con más detalle la forma, dosis y biodisponibilidad de los micronutrientes implicados.
Este enfoque evita el determinismo genético y sitúa el dato en su lugar correcto. Es decir, como modulador de riesgo, no como causa directa.
Implicaciones prácticas en suplementación
El ámbito donde más impacto tiene el conocimiento de MTHFR en consulta es, probablemente, la suplementación.
La presencia de variantes asociadas a menor eficiencia enzimática no implica suplementar de forma sistemática con folato activo, ni mucho menos excluir ácido fólico de forma generalizada. La decisión debe basarse en el conjunto de información clínica y bioquímica.
En algunos perfiles, este conocimiento puede justificar:
Revisar el tipo de folato utilizado, priorizando formas reducidas cuando existen indicios funcionales de baja conversión
Ajustar dosis para evitar tanto déficits como exposiciones innecesarias
Valorar la suplementación conjunta con otras vitaminas del grupo B implicadas en el ciclo de la metilación
Evitar estrategias innecesarias en pacientes asintomáticos con analíticas dentro de rango
Desde una perspectiva de medicina preventiva y longevidad, el objetivo es optimizar el entorno metabólico en función de la variabilidad individual, reduciendo riesgos a largo plazo.
Un caso de consulta frecuente: riesgo cardiovascular y homocisteína
En la práctica clínica, uno de los escenarios más habituales donde aparece MTHFR es la evaluación del riesgo cardiovascular en pacientes sin patología establecida, pero con antecedentes familiares o factores de riesgo moderados.
En estos casos, la información genética puede ayudar a contextualizar una homocisteína en rango alto-normal, especialmente cuando coexiste con otros marcadores subclínicos. No se trata de atribuir el riesgo al gen, sino de comprender por qué ese marcador responde peor a intervenciones estándar o por qué requiere un seguimiento más estrecho.
Este enfoque es especialmente relevante en consulta preventiva, donde pequeñas diferencias mantenidas en el tiempo pueden tener impacto a largo plazo.
MTHFR como ejemplo de cómo debería usarse la genética en consulta
El caso de MTHFR es paradigmático porque resume bien los límites y las oportunidades de la genética aplicada a la práctica clínica. No aporta diagnósticos, no sustituye a la clínica ni a la analítica, y no justifica intervenciones aisladas. Pero, bien interpretado, mejora la comprensión del paciente, refuerza la toma de decisiones y ayuda a personalizar estrategias nutricionales y de suplementación.
Para el profesional sanitario, el valor no está en “saber si un paciente tiene MTHFR”, sino en saber qué hacer con esa información —y, sobre todo, cuándo no hacer nada—.