Artículos de genética,
salud y prevención
En esta sección encontrarás contenidos orientados a la práctica profesional en salud, integrando el uso clínico de la información genética con su base científica.

Casos prácticos
Uso clínico de la información genética en la consulta, a partir de casos clínicos y escenarios habituales de práctica profesional.
Saber más

Investigación
Análisis de investigación científica, consensos y avances en genética con relevancia clínica y profesional.
Saber más
Últimos artículos:

Cronotipo en consulta: cómo identificar perfiles y personalizar la intervención
El cronotipo describe la fase circadiana preferente de cada individuo. No es una simple preferencia de horarios: refleja la organización interna del sistema reloj y condiciona secreción hormonal, metabolismo energético, rendimiento cognitivo y conducta alimentaria. Aproximadamente el 40-50% de su variabilidad interindividual tiene componente genético, y se han descrito asociaciones con genes reloj implicados también en regulación metabólica, como NR1D2
En la práctica clínica, el cronotipo se convierte en una variable útil cuando permite responder a tres preguntas:
¿Existe desalineación entre biología y entorno?
¿Está impactando en riesgo metabólico o afectivo?
¿Debemos modificar horarios antes que intensificar tratamiento farmacológico o dietético?
Además, el cronotipo adquiere relevancia cuando deja de ser descriptivo y pasa a guiar la intervención. La posibilidad de valorar la predisposición genética al cronotipo a través de la plataforma de N-GENE permite añadir una capa objetiva a la anamnesis y diferenciar entre hábito adquirido y arquitectura biológica de base.
Evaluación inicial: qué medir antes de interpretar el cronotipo

Antes de asignar un perfil circadiano y, sobre todo, antes de atribuir un problema a “cronotipo vespertino”, conviene realizar una evaluación al paciente. El objetivo es diferenciar entre cronotipo, cronodisrupción y trastorno del sueño coexistente.
En la anamnesis, es importante registrar primero el patrón de sueño con enfoque comparativo entre días laborables y libres. Anotar hora habitual de acostarse, latencia de sueño, número y duración de despertares, hora de despertar espontáneo en fines de semana y grado de somnolencia diurna. Este contraste permite cuantificar el jet lag social (diferencia entre la mitad del sueño en laborables vs libres) y detectar restricción crónica de sueño. A continuación, explora síntomas de otros trastornos del sueño que pueden confundir el cuadro: ronquido, pausas respiratorias, sueño no reparador, movimientos periódicos, piernas inquietas, cefalea matutina o nicturia. Si están presentes, la prioridad es descartar SAHS u otros trastornos antes de “culpar” al cronotipo.
En paralelo, integra un cribado de hábitos con impacto circadiano. Pregunta por exposición a pantallas y luz intensa en las 2-3 horas previas al sueño, consumo de cafeína (dosis total y horario), alcohol nocturno, nicotina, siestas (duración y hora), y variabilidad de horarios entre semana. Incluye medicación y suplementos con potencial efecto cronobiótico o sobre arquitectura del sueño (estimulantes, antidepresivos, betabloqueantes, hipnóticos, melatonina).
La tercera pieza es la evaluación del timing metabólico. En pacientes con sospecha de cronotipo vespertino, el impacto clínico suele venir mediado por el desplazamiento del comportamiento: ingesta tardía, mayor carga calórica nocturna y menor exposición lumínica matutina. Registra hora del primer aporte energético, distribución de calorías a lo largo del día, hora de la última comida, patrón de antojos vespertinos y relación entre estrés y alimentación nocturna. En el mismo bloque, documenta el momento del ejercicio (mañana/tarde/noche), porque condiciona temperatura corporal y fase circadiana.
Finalmente, mide cronotipo de forma operativa. Para clínica, basta una aproximación válida: cuestionario abreviado tipo MEQ/sMEQ o una pregunta estructurada (“¿te consideras más de mañana o de noche?”) acompañada de datos objetivos (hora de despertar espontáneo en días libres). La clave es no quedarse en la autoetiqueta, sino integrar conducta y fisiología.
Aquí es donde N-GENE añade utilidad práctica: al valorar la predisposición genética al cronotipo, aporta un marco biológico para interpretar si el patrón es predominantemente conductual o si existe una arquitectura circadiana de base que predispone a fase tardía. Esto es especialmente útil en pacientes que “hacen todo bien” pero mantienen una fase vespertina persistente.
Perfil 1: cronotipo vespertino con desalineación social

Es el más frecuente en consulta. El paciente tiende biológicamente a horarios tardíos y se ve obligado a madrugar. Aparecen restricción crónica de sueño, fatiga matutina, menor rendimiento temprano y compensación en fines de semana. Conductualmente suele observarse desplazamiento calórico hacia la tarde-noche y mayor exposición a pantallas por la noche.
Si la predisposición genética evaluada con N-GENE sugiere tendencia vespertina, el abordaje debe ser estructurado y gradual. La intervención se centra en reducir desalineación: exposición lumínica intensa a primera hora, reducción de luz azul nocturna, adelanto progresivo del horario de sueño y, de forma clave, adelanto de la ventana de alimentación. En estos pacientes, “acostarse antes” sin modificar luz e ingestas suele fracasar.
Perfil 2: cronotipo vespertino con vulnerabilidad metabólica
Son pacientes con adiposidad central, glucosa en rango alto-normal, hipertrigliceridemia o historia familiar de diabetes, que además concentran ingesta tarde y presentan sueño insuficiente. El cronotipo vespertino se ha asociado a mayor riesgo cardiometabólico, y parte de este riesgo puede estar mediado por desincronización circadiana y vías metabólicas compartidas
En este perfil, la evaluación inicial debe acompañarse de analítica dirigida: glucosa e insulina en ayunas (cálculo de HOMA-IR), HbA1c, perfil lipídico y, si procede, PCR ultrasensible. La intervención prioriza el timing: adelantar el primer aporte, reducir o adelantar la cena, evitar picos calóricos nocturnos y ubicar el ejercicio en la primera mitad del día cuando sea factible. Si N-GENE indica predisposición vespertina, conviene planificar un cambio más progresivo y mantener seguimiento más estrecho, porque la tendencia a recaer a horarios tardíos es mayor.
Perfil 3: cronotipo vespertino con vulnerabilidad afectiva
En este grupo aparecen insomnio de conciliación, rumiación nocturna, irregularidad horaria y reactividad emocional. El cronotipo tardío se ha vinculado a mayor prevalencia de sintomatología depresiva y menor bienestar subjetivo en poblaciones generales. En clínica, la evaluación inicial debe incluir cribado estructurado de ansiedad/depresión y revisión de factores psicosociales y de estrés mantenido.
Si la predisposición genética confirma arquitectura vespertina, no se trata de “falta de adherencia”, sino de un terreno biológico que puede amplificar la vulnerabilidad emocional en contextos de estrés. La intervención combina sincronización circadiana (luz matutina, rutina estable, higiene de estímulos nocturnos) con estrategias psicológicas cuando proceda, y requiere seguimiento longitudinal.
Qué aporta N-GENE en el manejo clínico del cronotipo

La valoración genética del cronotipo mediante N-GENE aporta una capa biológica que ayuda a interpretar persistencia del patrón, modular expectativas terapéuticas y ajustar intensidad de intervención. Permite identificar pacientes con mayor predisposición a fase tardía y, por tanto, con mayor riesgo de cronodisrupción mantenida en el tiempo cuando el entorno exige horarios tempranos.
Integrar cronotipo (clínica + conducta + predisposición genética) convierte una variable en una herramienta de medicina preventiva y de precisión.
Puedes consultar la información genética en el paquete de nutrigenética.

¿Qué información aporta la genética en el manejo del insomnio?
El insomnio es un marcador temprano de disfunción sistémica. En consulta es fácil ver pacientes con fatiga persistente, alteraciones metabólicas incipientes, mayor inflamación basal o deterioro cognitivo subjetivo, cuyo denominador común es un sueño crónicamente fragmentado. El problema no es solo dormir mal. Es lo que ese mal dormir anticipa.
La evidencia ha demostrado que el insomnio presenta heredabilidad significativa y comparte arquitectura genética con depresión mayor y diabetes tipo 2, además de correlacionar negativamente con cronotipo matutino y bienestar subjetivo. Esto redefine su papel clínico: no es únicamente consecuencia, también es predisposición.
En medicina preventiva, esta información cambia (o debería cambiar) totalmente enfoque.
Los 3 ejes fisiopatológicos predominantes del insomnio
En la práctica clínica, el insomnio suele integrarse en uno de estos tres ejes fisiopatológicos predominantes:
1. Eje metabólico
Paciente con glucosa en rango alto-normal, resistencia a la insulina incipiente o adiposidad visceral aumentada, que presenta insomnio de mantenimiento. Cuando existe predisposición genética compartida con riesgo metabólico, el insomnio puede actuar como factor amplificador de desregulación glucémica. En estos casos, la práctica clínica no debe limitarse a mejorar la calidad del sueño. Debe incluir:
Monitorización más estrecha de glucosa, insulina y HbA1c.
Evaluación de inflamación basal (PCR ultrasensible).
Intervenciones dirigidas a sincronización circadiana y crononutrición.
El objetivo es modificar la trayectoria metabólica antes de que aparezca enfermedad manifiesta.
2. Eje neuroafectivo
Paciente con insomnio de conciliación, reactividad al estrés elevada y sintomatología afectiva subclínica. La correlación genética entre insomnio y depresión mayor indica que en algunos casos el insomnio puede preceder o compartir base biológica con el trastorno afectivo. En este perfil, la práctica clínica debería incorporar:
Cribado estructurado de sintomatología depresiva y ansiosa.
Seguimiento longitudinal más estrecho.
Intervención psicológica precoz cuando proceda.
Aquí el insomnio puede funcionar como marcador precoz de vulnerabilidad psiquiátrica, no solo como síntoma secundario.
3. Eje circadiano

Paciente con cronotipo vespertino marcado, jet lag social persistente y dificultad para adaptar el sueño a horarios laborales convencionales. Cuando la predisposición genética apunta hacia desincronización circadiana, la intervención debe ser cronobiológica:
Evaluación estructurada de cronotipo.
Optimización de exposición lumínica.
Ajuste de horarios de ingesta y ejercicio.
Consideración de terapia con melatonina en timing específico.
En este contexto, el tratamiento farmacológico aislado suele ser insuficiente si no se corrige el desajuste circadiano subyacente.
El valor de integrar la información genética
En medicina preventiva, no deberíamos buscar la confirmación de que un paciente duerme mal, sino entender qué implica ese insomnio para su riesgo futuro y cómo debemos actuar en consecuencia. Integrar información genética supone añadir precisión clínica.
Cuando incorporamos predisposición genética al insomnio en la valoración médica, ocurren cuatro cambios prácticos y muy concretos en la personalización:
Identificamos qué pacientes son de alto riesgo
No todos los insomnios tienen la misma carga biológica. Si un paciente presenta una predisposición genética elevada y sabemos que el insomnio comparte arquitectura con diabetes tipo 2 o depresión mayor, ese paciente deja de ser un caso de manejo sintomático. Se convierte en un perfil de riesgo que requiere:
Evaluación metabólica más rigurosa aunque los parámetros estén en rango límite.
Cribado afectivo estructurado aunque no exista diagnóstico formal.
Seguimiento longitudinal planificado, no reactivo.
La genética permite distinguir entre el paciente que necesita educación en higiene del sueño y el que necesita vigilancia preventiva intensiva.
Ajustamos la intensidad y frecuencia del seguimiento
Un paciente con baja carga genética y perfil circadiano leve puede requerir revisión anual. En cambio, un paciente con predisposición genética asociada a riesgo metabólico o afectivo puede beneficiarse de:
Control semestral de parámetros glucémicos.
Reevaluación periódica de síntomas afectivos.
Monitorización más estrecha de inflamación basal.
No se trata de hacer más pruebas indiscriminadamente. Sino de decidir quién necesita más vigilancia y por qué.
Priorizamos intervenciones personalizadas
Sin estratificación biológica, el tratamiento del insomnio tiende a homogeneizarse: higiene del sueño, ocasionalmente hipnóticos, y seguimiento sintomático.
Con información genética podemos priorizar mejor:
Si el eje es metabólico, personalizamos crononutrición y sincronización circadiana.
Si el eje es afectivo, incorporamos intervención psicológica precoz.
Si el eje es circadiano, aplicamos protocolos de luz, tratamiento con melatonina y ajuste horario estructurados.
El abordaje deja de ser genérico y pasa a ser dirigido por el terreno biológico predominante.
Reducimos la sobremedicalización innecesaria
Muchos pacientes con insomnio reciben tratamiento farmacológico prolongado sin haber identificado el mecanismo predominante. Si el perfil genético sugiere desincronización circadiana como eje principal, la solución no es sedar, sino resincronizar. Si el riesgo es metabólico, el fármaco no modifica la trayectoria glucémica.
Conocer la genética de los pacientes ayuda a evitar tratamientos que alivian el síntoma sin modificar el riesgo subyacente.
Desde N-GENE permitimos identificar qué insomnio es probablemente transitorio y cuál puede formar parte de una vulnerabilidad sistémica más amplia. Para que, de esta forma, los profesionales de la salud puedan decidir qué paciente necesita intervención intensiva y cuál seguimiento estándar. Permite priorizar prevención frente a reacción.
Puedes encontrar los resultados de insomnio en el paquete de Neurología.

Uso de la nutrigenética en la salud metabólica y glucémica del paciente
En consulta, muchos pacientes llegan con la preocupación de, aparentemente, estar haciéndolo “todo bien”, pero el peso no baja, el hambre persiste y la grasa abdominal parece resistente a cualquier estrategia.
La analítica básica, centrada en la glucosa en ayunas, suele devolver resultados aparentemente normales, lo que genera frustración tanto en el paciente como en el profesional. En este contexto, la información nutrigenética relacionada con la liberación de insulina, la retirada de glucosa y la predisposición a resistencia a la insulina puede marcar la diferencia como herramienta para anticipar, afinar la intervención y acortar tiempos en la toma de decisiones clínicas.
Un perfil frecuente en consulta
Paciente de mediana edad, sin patología metabólica diagnosticada, con un IMC dentro de la normalidad o ligeramente elevado. Refiere dificultad para perder peso pese a seguir pautas dietéticas estructuradas, hambre frecuente —especialmente a media mañana y a última hora del día— y una acumulación de grasa claramente central. La exploración revela aumento de grasa visceral, perímetro de cintura elevado para su contexto corporal y, en algunos casos, antecedentes familiares de diabetes tipo 2 o síndrome metabólico.
La analítica básica muestra una glucosa en ayunas dentro de rango. No hay un “dato alarmante” que justifique, a priori, un abordaje más profundo. Sin embargo, el cuadro clínico sugiere que la regulación de la glucosa no es óptima, aunque todavía no se exprese en forma de hiperglucemia.
Es en este punto donde la nutrigenética aporta valor clínico. Especialmente, si conocemos esta información de base.
Qué información aporta la nutrigenética en el perfil glucémico del paciente
Los rasgos nutrigenéticos relacionados con la glucosa nos hablan de una variabilidad en procesos fisiológicos clave: cómo se libera la insulina tras una ingesta, qué eficiencia tiene la captación de glucosa por los tejidos periféricos y cómo responde el organismo a cargas repetidas de hidratos de carbono.
Desde el punto de vista práctico, esta información permite identificar de forma rápida y precisa aquellos perfiles con:
Mayor tendencia a una respuesta insulinémica exagerada.
Menor eficiencia en la retirada de glucosa tras las comidas.
Predisposición a desarrollar resistencia a la insulina en contextos de exceso energético, sedentarismo o estrés metabólico.
Estos rasgos no determinan el resultado final, pero modulan el terreno sobre el que actúan la dieta, el estilo de vida y el paso del tiempo. Y, en algunos casos, ya lo estamos viendo con nuestro paciente.
En el caso descrito, la información genética permite entender por qué una glucosa en ayunas normal no es sinónimo de buena salud metabólica. La alteración inicial en la resistencia a la insulina suele manifestarse primero en el periodo postprandial, no en ayunas.
Este conocimiento cambia el enfoque clínico. En lugar de asumir que “todo está bien” hasta que la glucosa se altere, el profesional puede anticiparse y decidir solicitar una analítica más completa: insulina basal, HOMA-IR, perfil lipídico detallado o incluso marcadores inflamatorios de bajo grado.
La nutrigenética, en este contexto, justifica ampliar la analítica cuando la clínica no encaja con los resultados básicos.
Aplicación práctica en la intervención nutricional
Una vez integrado este perfil, la estrategia nutricional cambia de forma significativa. No se trata de restringir más a ese paciente que ya viene haciendo dietas estrictas, limitando carbohidratos y con un hambre descontrolada. Se trata de regular mejor.
En pacientes con predisposición a una respuesta insulinémica elevada, cobra especial relevancia:
El reparto de macronutrientes
El orden de ingesta de los alimentos
La calidad y el tipo de hidratos de carbono
La presencia suficiente de proteína y fibra en cada comida
Este enfoque explica por qué dietas aparentemente correctas pueden no funcionar en determinados perfiles y por qué pequeños ajustes —más que grandes restricciones— generan mejoras en saciedad, control del apetito y evolución de la grasa visceral.
Hambre persistente y frustración: una señal metabólica, no de falta de adherencia
Uno de los puntos relevantes a tener en cuenta en este tipo de casos clínicos es reencuadrar el hambre. En muchos pacientes con predisposición a resistencia a la insulina, el hambre frecuente no es un problema de voluntad, sino una consecuencia de picos y caídas rápidas de glucosa e insulina.
Conocer la información genética del paciente permite explicar este fenómeno al mismo desde un enfoque fisiológico, reduciendo la culpa y mejorando la adherencia. Desde el punto de vista profesional, facilita diseñar estrategias que prioricen la estabilidad glucémica frente a la simple reducción calórica.
Este cambio de narrativa es especialmente relevante en medicina preventiva y nutrición de precisión, donde el objetivo no es solo perder peso, sino mejorar la salud metabólica a largo plazo.
En algunos pacientes, la información que aporta la nutrigenética también ayuda a contextualizar el uso de determinados suplementos orientados a la regulación de la glucosa y la sensibilidad a la insulina, como apoyo dentro de una estrategia.
El valor está en saber cuándo tiene sentido considerar un apoyo nutricional y cuándo no, evitando tanto el uso indiscriminado como la infrautilización por falta de criterios claros.
Acortar tiempos en consulta: uno de los grandes beneficios
Desde la perspectiva del profesional, uno de los mayores beneficios de integrar esta información es el ahorro de tiempo. En lugar de probar múltiples enfoques durante meses sin una hipótesis clara, la nutrigenética permite:
Identificar antes los perfiles de riesgo
Solicitar analíticas más completas desde el inicio
Ajustar la intervención nutricional con mayor precisión
Evitar frustración tanto en el paciente como en el profesional
En medicina preventiva, donde el objetivo es adelantarse a la patología, este enfoque resulta especialmente valioso. Cuando la información genética se integra con clínica, analítica y contexto de vida, permite intervenir antes de que aparezca una alteración franca, optimizando resultados y mejorando la adherencia del paciente.
Disponer de esta información no cambia solo qué se hace en consulta, sino cuándo y por qué se hace.

¿Está escrita la longevidad en tu ADN? Lo que dice la ciencia
¿Por qué algunas personas alcanzan edades avanzadas con buena funcionalidad metabólica y cognitiva, mientras otras desarrollan enfermedades crónicas décadas antes? Durante años, la investigación ha intentado cuantificar el peso relativo de la genética frente a los factores ambientales, con resultados que, a menudo, se han simplificado en exceso.
La evidencia actual apunta a una conclusión más matizada: la genética no determina de forma directa cuántos años vivimos, pero sí influye de manera relevante en cómo envejecemos y en nuestra susceptibilidad a trayectorias de salud concretas. Comprender esta diferencia es fundamental para aplicar la información genética de forma rigurosa en medicina preventiva.
¿Qué porcentaje de la longevidad depende realmente del ADN?
Los primeros estudios familiares y de gemelos estimaban que la heredabilidad de la longevidad se situaba en torno al 20–25%, especialmente cuando se analizaba la población general. Investigaciones más recientes, basadas en cohortes amplias y modelos estadísticos más refinados, sugieren que este porcentaje puede ser mayor cuando se analizan muertes no accidentales y envejecimiento extremo.
Lo que actualmente parece más claro es que la genética tiene un peso creciente a partir de edades avanzadas. Influye especialmente en mecanismos biológicos del envejecimiento, como la reparación del ADN, inflamación, metabolismo lipídico, respuesta al estrés celular o mantenimiento de la proteostasis. Y además, actúa modulando la respuesta del organismo al entorno.
Desde una perspectiva clínica, esto se traduce en que los genes condicionan la “vulnerabilidad basal” sobre la que actúan los factores modificables.
Longevidad no es un gen: es una red de procesos biológicos

El envejecimiento es un proceso complejo que resulta de la interacción entre múltiples rutas moleculares, reguladas por conjuntos de variantes genéticas cuyos efectos individuales son modestos, pero que adquieren relevancia de forma acumulativa a lo largo del tiempo.
Desde la perspectiva de la genética aplicada a la longevidad, el interés no se centra en una variante aislada, sino en cómo determinados perfiles genéticos influyen en procesos biológicos clave, como el metabolismo lipídico y el riesgo cardiovascular, el mantenimiento de la función neuronal y la neuroinflamación, la respuesta al estrés oxidativo, la reparación del ADN y la estabilidad genómica, así como la regulación de la inflamación crónica de bajo grado. A continuación, se describen algunos de los genes más estudiados en este contexto.
APOE: longevidad, metabolismo lipídico y riesgo neurovascular
El gen APOE es uno de los mejor caracterizados en envejecimiento, ya que condiciona el riesgo de patologías que acortan la esperanza de vida saludable, especialmente las de origen cardiovascular y neurodegenerativo.
El alelo APOE4 se asocia a un mayor riesgo de enfermedad cardiovascular, Alzheimer y mortalidad temprana. Su efecto es dependiente del contexto metabólico y del estilo de vida. Actualmente, la evidencia muestra que las intervenciones dietéticas, el control lipídico y el manejo de la inflamación pueden modificar significativamente el impacto clínico de este genotipo.
Desde la práctica clínica, conocer el estado de APOE permite estratificar riesgo y priorizar estrategias preventivas.
FOXO3 y la resiliencia celular
FOXO3 es uno de los genes más consistentemente asociados a la longevidad en diferentes poblaciones, y su interés clínico reside en su función como regulador central de los mecanismos de mantenimiento celular. FOXO3 participa en la activación de vías de resistencia al estrés, la regulación de la autofagia, el control del ciclo celular y de los procesos de apoptosis, así como en el mantenimiento de la funcionalidad de las células madre.
Las variantes genéticas que modulan su actividad influyen en la capacidad del organismo para responder al daño celular acumulado a lo largo del tiempo. En este contexto, estrategias como el ejercicio físico, la restricción calórica intermitente y determinados estímulos metabólicos pueden actuar como moduladores funcionales de estas rutas biológicas, favoreciendo su activación con independencia del genotipo y reforzando así la importancia de integrar genética y estilo de vida en un enfoque preventivo.
Reparación del ADN, inflamación y envejecimiento biológico
El envejecimiento está estrechamente ligado a la acumulación progresiva de daño genómico y a la pérdida de eficiencia de los mecanismos de mantenimiento celular. En este contexto, genes implicados en la reparación del ADN y en la regulación de la inflamación, como las sirtuinas, desempeñan un papel relevante en la preservación de la estabilidad celular a largo plazo.
La evidencia en humanos indica que las variantes genéticas que afectan a estas rutas biológicas influyen en la velocidad de deterioro funcional asociada al envejecimiento, especialmente en entornos caracterizados por inflamación crónica de bajo grado, estrés oxidativo y disfunción metabólica. Desde una perspectiva clínica, su principal valor reside en la identificación de perfiles con mayor susceptibilidad al daño acumulado, en los que la intervención preventiva temprana puede tener un impacto significativo en la trayectoria de salud.
Reparación del ADN, inflamación y envejecimiento biológico

Uno de los avances conceptuales más relevantes en el campo de la longevidad es el tránsito desde una visión estática del envejecimiento hacia un enfoque dinámico, en el que se reconoce que las personas no envejecen al mismo ritmo, incluso cuando comparten la misma edad cronológica.
Desde esta perspectiva, la información genética permite identificar una mayor o menor susceptibilidad a trayectorias de envejecimiento acelerado, siempre entendida como un factor modulador. Su utilidad clínica aumenta de forma significativa cuando se integra con biomarcadores clínicos, inflamatorios y metabólicos, ya que esta combinación permite contextualizar el riesgo y comprender mejor la evolución biológica individual. El objetivo de este enfoque es anticipar escenarios de riesgo y modularlos mediante intervenciones tempranas, lo que resulta especialmente relevante en el ámbito de la medicina preventiva, donde actuar antes de la aparición de enfermedad puede modificar de forma sustancial la calidad de vida.
Genética dinámica: cuando el conocimiento evoluciona
Un aspecto clave en la aplicación clínica de la genética es asumir que el ADN no cambia, pero la interpretación científica sí. La genética moderna ya no puede entenderse como un informe estático, sino como un sistema de conocimiento en actualización constante.
A medida que la evidencia avanza, la interpretación de variantes, su peso clínico y su integración en modelos de riesgo se refinan. Para el profesional sanitario, esto implica disponer de herramientas que permitan revisar y actualizar la información genética a la luz de nuevos hallazgos, manteniendo la coherencia clínica. Por ello, desde la plataforma N-GENE el ADN de tus pacientes siempre está actualizado.
Genética como herramienta de prevención, no de predicción
La longevidad no está predeterminada, pero tampoco es aleatoria. La genética no dicta el destino, aunque sí condiciona el terreno biológico sobre el que actúan los factores modificables a lo largo de la vida. Aplicada con rigor clínico, la información genética permite estratificar el riesgo, priorizar intervenciones, personalizar estrategias preventivas y anticiparse a trayectorias de envejecimiento menos favorables antes de que se manifiesten clínicamente.
En el abordaje de la longevidad, el objetivo no es únicamente prolongar la vida, sino preservar la funcionalidad y la calidad de vida durante más tiempo; en este sentido, la genética constituye una herramienta de alto valor en medicina preventiva cuando se integra de forma adecuada con la evaluación clínica y el seguimiento continuado del paciente.

Qué información aporta realmente MTHFR
El gen MTHFR ha sido uno de los más solicitados —y también uno de los más malinterpretados— en el ámbito de la nutrigenética y la medicina preventiva. Asociado de forma simplista a fatiga, problemas cardiovasculares, infertilidad o “mala metilación”, su análisis ha generado tanto expectativas irreales como rechazo entre profesionales. Sin embargo, cuando se integra correctamente, el conocimiento genético sobre MTHFR puede convertirse en una herramienta útil para comprender variabilidad metabólica, ajustar decisiones clínicas y personalizar la suplementación.
Más allá del “tienes o no tienes el gen”: qué información aporta realmente MTHFR
En consulta, el primer aspecto a tener en cuenta al trabajar con MTHFR es desactivar el enfoque dicotómico. No existen “pacientes MTHFR” ni mutaciones patológicas per se en la mayoría de los casos, sino variantes genéticas frecuentes en la población general que modulan la eficiencia de una enzima clave del metabolismo del folato.
La enzima MTHFR participa en la conversión de 5,10-metilentetrahidrofolato en 5-metiltetrahidrofolato, una forma activa de folato necesaria para la remetilación de la homocisteína a metionina. Determinadas variantes genéticas se asocian con una actividad enzimática reducida, especialmente en condiciones de bajo aporte dietético de folatos, déficit de vitaminas del grupo B o mayor demanda metabólica.
Desde el punto de vista clínico, esta información no permite diagnosticar ninguna patología, pero sí aporta contexto. Ayuda a entender por qué, ante un mismo entorno nutricional o estilo de vida, algunas personas muestran mayor tendencia a presentar homocisteína elevada, peor respuesta a determinados suplementos o mayor sensibilidad a déficits funcionales de folato.
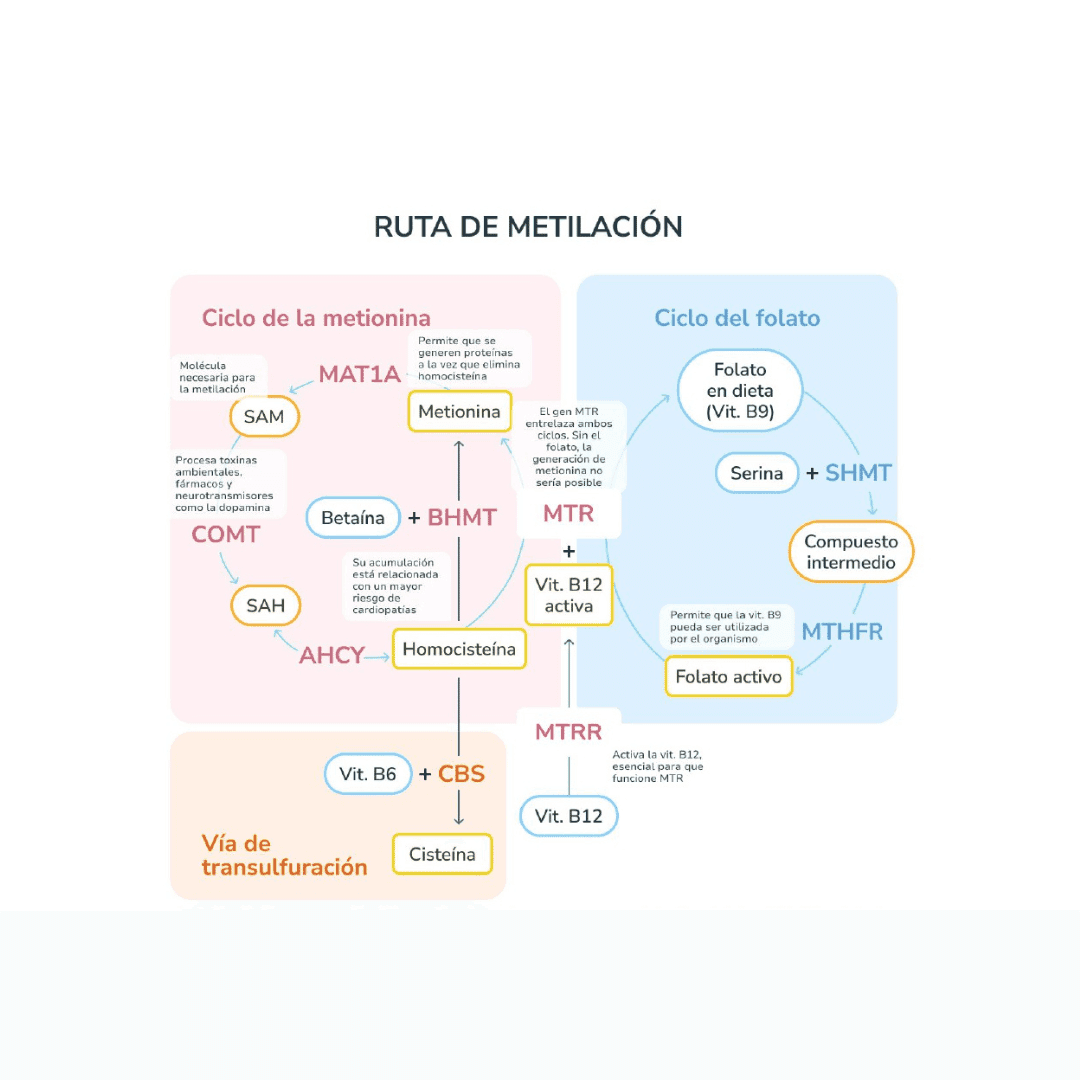
El valor clínico está en la integración, no en el gen aislado
Uno de los errores más frecuentes es interpretar MTHFR de forma aislada, sin considerar el resto de variables clínicas y bioquímicas. En la práctica profesional, su utilidad emerge solo cuando se integra con:
Analítica (homocisteína, folato sérico y eritrocitario, vitamina B12, B6)
Estado nutricional y patrón dietético del paciente
Situaciones fisiológicas concretas (embarazo, envejecimiento, inflamación crónica, estrés metabólico)
Otros rasgos genéticos relacionados con el metabolismo del folato, la metilación o el estrés oxidativo
En este contexto, MTHFR no “explica” síntomas por sí mismo, pero puede ayudar a priorizar hipótesis clínicas. Por ejemplo, ante un paciente con homocisteína persistentemente elevada pese a una dieta aparentemente adecuada, la presencia de ciertas variantes puede orientar a revisar con más detalle la forma, dosis y biodisponibilidad de los micronutrientes implicados.
Este enfoque evita el determinismo genético y sitúa el dato en su lugar correcto. Es decir, como modulador de riesgo, no como causa directa.
Implicaciones prácticas en suplementación
El ámbito donde más impacto tiene el conocimiento de MTHFR en consulta es, probablemente, la suplementación.
La presencia de variantes asociadas a menor eficiencia enzimática no implica suplementar de forma sistemática con folato activo, ni mucho menos excluir ácido fólico de forma generalizada. La decisión debe basarse en el conjunto de información clínica y bioquímica.
En algunos perfiles, este conocimiento puede justificar:
Revisar el tipo de folato utilizado, priorizando formas reducidas cuando existen indicios funcionales de baja conversión
Ajustar dosis para evitar tanto déficits como exposiciones innecesarias
Valorar la suplementación conjunta con otras vitaminas del grupo B implicadas en el ciclo de la metilación
Evitar estrategias innecesarias en pacientes asintomáticos con analíticas dentro de rango
Desde una perspectiva de medicina preventiva y longevidad, el objetivo es optimizar el entorno metabólico en función de la variabilidad individual, reduciendo riesgos a largo plazo.
Un caso de consulta frecuente: riesgo cardiovascular y homocisteína
En la práctica clínica, uno de los escenarios más habituales donde aparece MTHFR es la evaluación del riesgo cardiovascular en pacientes sin patología establecida, pero con antecedentes familiares o factores de riesgo moderados.
En estos casos, la información genética puede ayudar a contextualizar una homocisteína en rango alto-normal, especialmente cuando coexiste con otros marcadores subclínicos. No se trata de atribuir el riesgo al gen, sino de comprender por qué ese marcador responde peor a intervenciones estándar o por qué requiere un seguimiento más estrecho.
Este enfoque es especialmente relevante en consulta preventiva, donde pequeñas diferencias mantenidas en el tiempo pueden tener impacto a largo plazo.
MTHFR como ejemplo de cómo debería usarse la genética en consulta
El caso de MTHFR es paradigmático porque resume bien los límites y las oportunidades de la genética aplicada a la práctica clínica. No aporta diagnósticos, no sustituye a la clínica ni a la analítica, y no justifica intervenciones aisladas. Pero, bien interpretado, mejora la comprensión del paciente, refuerza la toma de decisiones y ayuda a personalizar estrategias nutricionales y de suplementación.
Para el profesional sanitario, el valor no está en “saber si un paciente tiene MTHFR”, sino en saber qué hacer con esa información —y, sobre todo, cuándo no hacer nada—.